ニュース
2013年10月08日
糖尿病の新たな分子機構を解明 細胞老化の原因タンパク質を発見
- キーワード
- 医療の進歩
脂肪の老化と炎症を結ぶカギ分子の同定
p53遺伝子は、正常な細胞にあるがん抑制遺伝子の一種。正常細胞では、p53遺伝子がごく低レベルで発現しており、発がん遺伝子の活性化などが起こるとp53遺伝子の発現は活性化する。p53シグナルが過剰になると細胞は老化し、加齢にともなうさまざまな疾患が増えると考えられている。
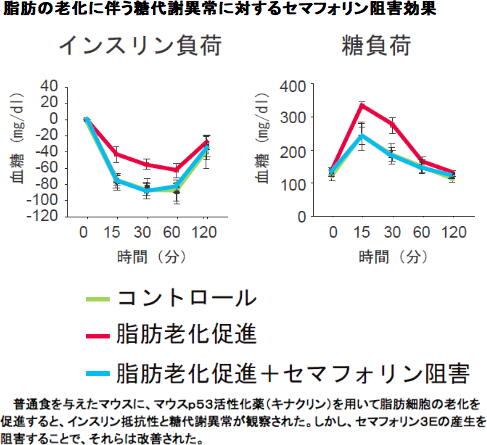
南野教授らは過去の研究で、細胞の老化や染色体傷害によってp53依存性のシグナルが引き起こされ、細胞の老化が血管の老化・動脈硬化に関与していることを明らかにした。肥満にともなう内臓脂肪の老化により、p53依存性のシグナルの活性化が引き起こされ、脂肪組織の炎症とインスリン抵抗性を引き起こしているという。
南野教授らが今回解明したのは、タンパク質「セマフォリン3E」が脂肪細胞の老化と脂肪組織の炎症を結ぶカギ分子として働くことだ。セマフォリン3Eの受容体としては、「プレキシンD1」が同定されている。
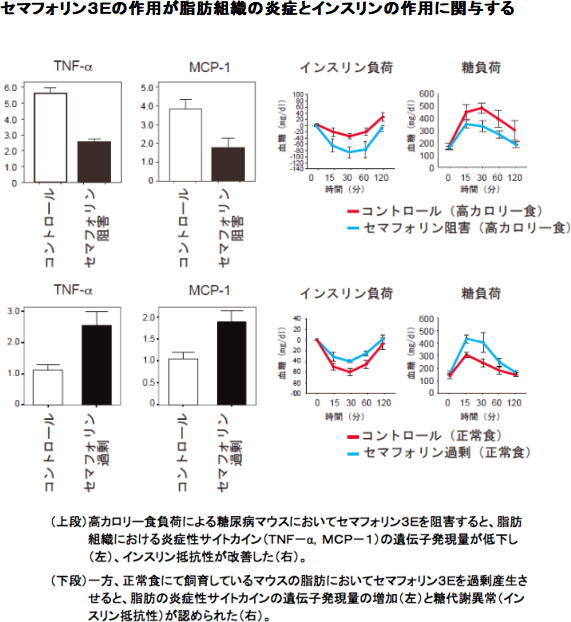
まず、内臓脂肪におけるセマフォリン3Eの産生量についての検討を行い、2型糖尿病を発症したマウスの脂肪細胞で発現量が増加していることを確認した。この2型糖尿病マウスに、セマフォリン阻害薬を投与したり、あるいはセマフォリン3E遺伝子の欠損マウスに高カロリー食を与えると、脂肪組織の炎症は抑制され、インスリン抵抗性は改善した。逆に、セマフォリン3Eを脂肪組織で過剰に産生させたマウスモデルでは、脂肪組織の炎症が起こり、糖代謝異常が認められた。
[ Terahata ]
日本医療・健康情報研究所
医療の進歩の関連記事
- 息で糖尿病を検出するセンサーが開発進行中
- 先進医療技術の普及により1型糖尿病患者の血糖管理が大きく改善
- 注射だけでない未来へ「飲むインスリン」研究のいま
- 糖尿病の治療薬メトホルミンが長寿に関係 老化を遅らせ寿命を延ばす薬に期待
- 【1型糖尿病の最新情報】幹細胞から分化した膵島細胞を移植 インスリンが不要になり重症低血糖もゼロに
- 【1型糖尿病の最新情報】発症からインスリン枯渇までの期間を予測 より効果的な治療を期待 日本初の1型糖尿病研究
- 「異種移植」による腎臓移植が最長記録 米国で臨床試験の開始を公表
- 最新版!『血糖記録アプリ早見表2025-2026』を公開
- 腎不全の患者さんを透析から解放 「異種移植」の扉を開く画期的な手術が米国で成功
- 【歯周病ケアにより血糖管理が改善】糖尿病のある人が歯周病を治療すると人工透析のリスクが最大で44%減少

 医療・健康情報グループ検索
医療・健康情報グループ検索